La microfluidique dans l’industrie
Dans cet article de notre série consacrée aux laboratoires sur puces microfluidiques, nous allons nous pencher sur certains principes de base régissant la détection ou la quantification d’une cible biochimique au sein d’un échantillon.
Les principes de détection reposent sur un ou plusieurs des éléments qui suivent :
- biorécepteur susceptible de se lier très spécifiquement à la cible
- méthode d’augmentation de la concentration de la cible, afin d’améliorer la sensibilité du test
- molécule marqueuse éventuelle reliée au biorécepteur afin de faciliter la détection
- capteur permettant d’évaluer la présence de la cible liée, voire de la quantifier.
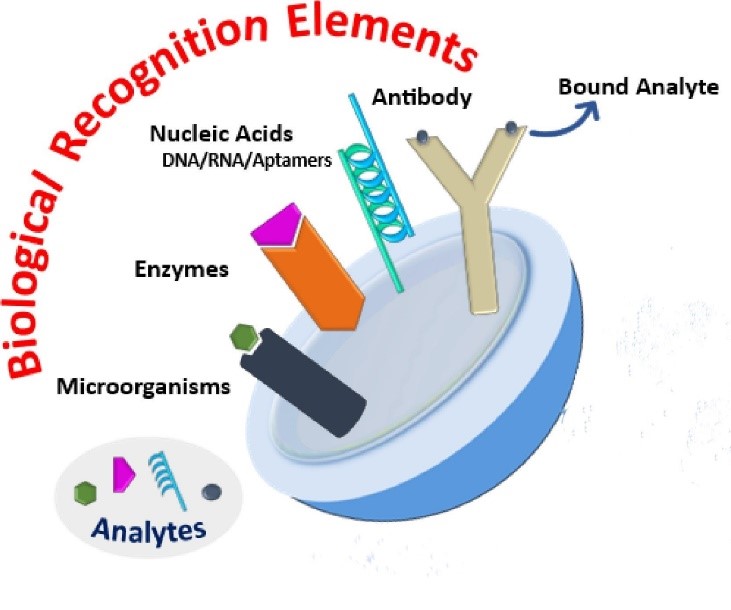
Biorécepteur
Le développement d’un biorécepteur approprié relève de la biochimie. Il est important que ce biorécepteur soit sélectif ; en d’autres termes, qu’il ne se lie qu’à la cible et non à des molécules similaires présentes dans l’échantillon, au risque de provoquer l’obtention de résultats faussement positifs. Le biorécepteur est généralement une enzyme, un anticorps ou un acide nucléique.
Concentration de la cible
Les techniques de concentration constituent un autre aspect majeur, dans la mesure où elles permettent d’amplifier le signal à mesurer et partant, d’accroître la fiabilité de la détection.
L’une des méthodes d’augmentation de la concentration consiste à « amplifier » la cible au sein de l’échantillon. Cette méthode est envisageable lorsque la cible est un acide nucléique, tel que l’ADN ou l’ARN. La réaction en chaîne par polymérase (RCP) permet de répliquer la partie spécifique de l’ADN/ARN que nous devons détecter, en doublant de la sorte la quantité de la cible que présente l’échantillon. La réitération de cette opération à trente reprises, par exemple, permet de multiplier par un milliard la quantité de la cible !
Une autre méthode d’augmentation de la concentration de la cible réside dans l’application du biorécepteur sur une surface de détection spécifique. Il peut s’agir d’une surface fixe située dans la zone de détection de la puce microfluidique. En comparaison avec un environnement d'essai macroscopique, cet environnement microfluidique présente l’avantage déterminant de bénéficier d’un rapport surface/volume important, lequel augmente sensiblement la probabilité d’entrée en contact des molécules cibles avec les biorécepteurs de surface.
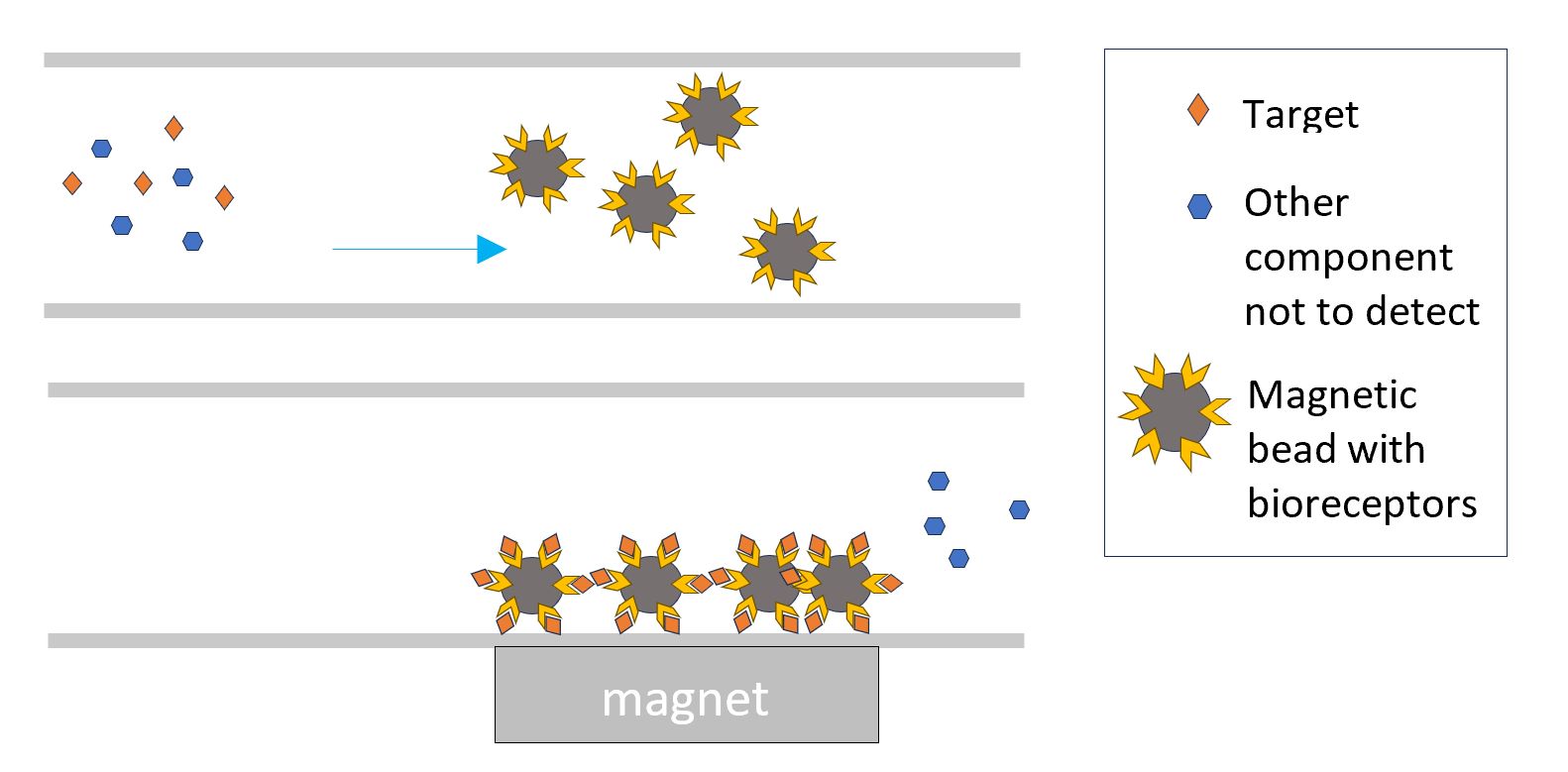
Ces biorécepteurs peuvent aussi être liés à des particules magnétiques. L’interaction de la cible avec ces particules magnétiques est susceptible de se produire dans l’ensemble du volume plutôt qu’au niveau d’une surface fixe. L’attraction ultérieure de ces particules magnétiques vers une zone de détection intégrée à la puce permet de concentrer la cible détectée dans cette zone.
De même, les biorécepteurs sont susceptibles d’être liés à de grosses particules dont la capture par un élément filtrant permet d’augmenter la concentration de la cible.
Détection de la cible
Après avoir concentré la cible liée, l'étape suivante consiste à la détecter. Plusieurs options sont également envisageables à ce stade.
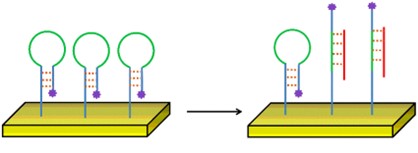
Le biorécepteur est susceptible d’être lié à un fluorophore de manière que ce dernier ne soit visible que lorsque la cible est liée au biorécepteur (p. ex., sonde à structure en épingle à cheveux). C’est ce que l’on a coutume d’appeler une détection étiquetée.
Ou bien des propriétés électrochimiques de la cible ou du biorécepteur lié sont susceptibles d’être mesurées par ampérométrie, impédancemétrie, potentiométrie ou voltampérométrie.
Les propriétés électriques de la surface de détection (résistance, capacité, inductance) peuvent évoluer en fonction de la quantité de cible liée.
Mécaniquement, la surface de détection peut se déformer sous l’effet du poids supplémentaire de la cible liée ou voir sa fréquence de résonance se déplacer.
La cible en tant que telle ou le marqueur activé sur le biorécepteur sont susceptibles de fluorescer ou d’émettre de la lumière. Ils peuvent modifier les propriétés optiques de la surface de détection et l’absorption, la dispersion ou la réfraction de la lumière incidente. Dans le cas le plus simple, la surface de détection change de teinte en présence d’une cible liée. D’autres techniques permettent également des analyses très fines via la mesure de variations d’indice de réfraction de la surface en fonction des espèces qui s’y lient (e.g. résonance de plasmons de surface).
Capteur
La dernière étape consiste alors à utiliser un capteur adéquat pour détecter/surveiller/quantifier cette fluorescence, l’intensité de la lumière ou son spectre, ou encore pour suivre l’évolution des propriétés électriques, mécaniques ou optiques de la surface de détection.
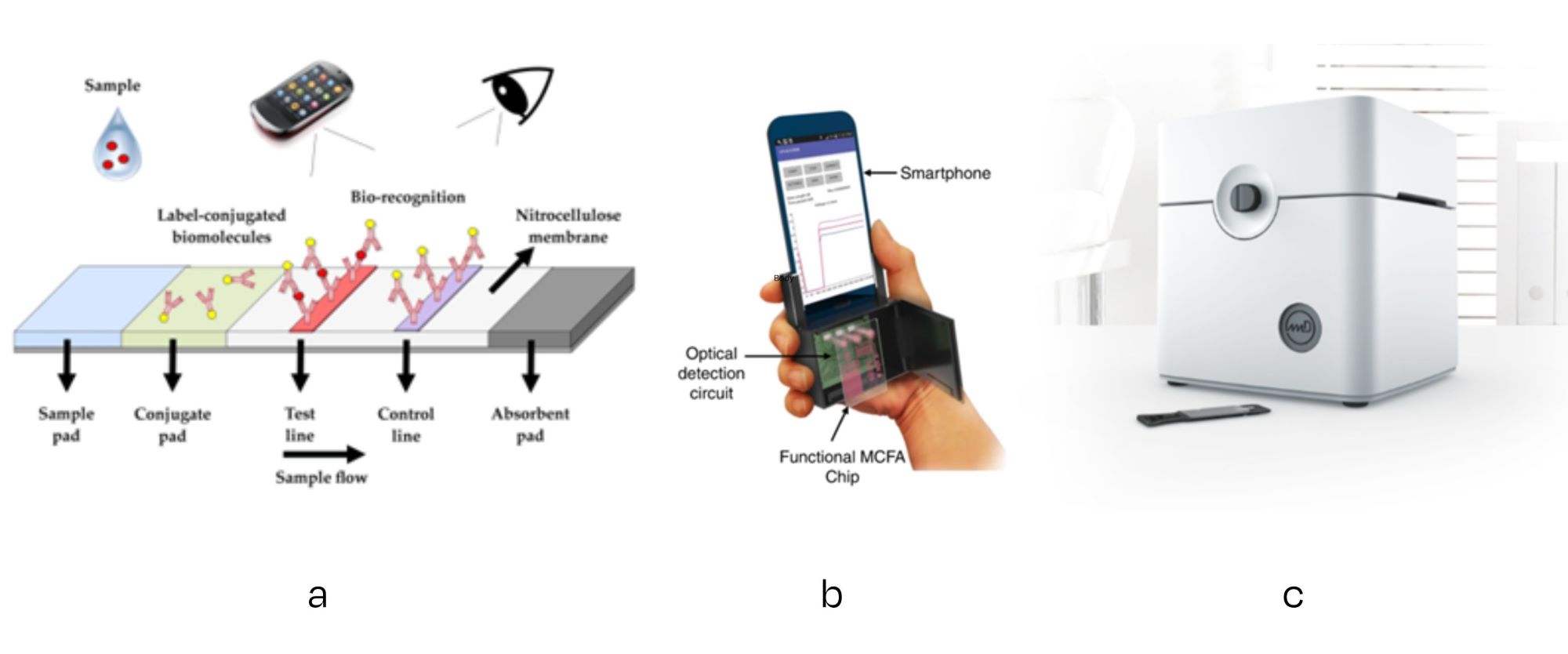
La solution la plus simple de détection des changements de teinte, permet à l’utilisateur de voir à l’œil nu le résultat du test effectué (à l’instar d’un test de grossesse, d’un test d’autodépistage de la covid ou de frottis de surveillance). Le stade suivant pourrait résider dans l’utilisation d’un smartphone pour interpréter de manière plus quantitative tout changement optique relevé dans la zone de détection.
Des solutions plus avancées consisteront en diverses combinaisons d’actionneurs/capteurs personnalisés, dans le but d’appliquer le vecteur d’excitation requis (tension/courant/vibration/lumière) et de mesurer la réponse (électrique, électrochimique, mécanique, optique). Certaines solutions s’avéreront relativement simples et peu onéreuses. Exemple : une caméra de détection optique par réflexion de la lumière.
Bref, c’est ainsi que seront détectées les cibles biologiques présentes dans un échantillon, indépendamment du type d’application (diagnostics médicaux, tests portant sur des plantes, animaux, environnements, aliments, ...).
Dans les articles précédents, nous avons déjà discuté des étapes de conception et des techniques de prototypage pour le développement d’une puce microfluidique dédiée. Nous avons également présenté une solution basée sur une caméra pour contrôler le flux dans la puce. Dans le prochain article, nous nous pencherons sur l'aspect du contrôle thermique dans la puce, un facteur critique pour la réalisation de la PCR.
Vous avez une idée de laboratoire sur puce ? Les connaissances et les installations de production nécessaires pour développer et produire ces dispositifs localement sont disponibles en Belgique. Nous pouvons vous aider à vous lancer sur base de votre idée.
Financement du projet
VLAIO COOCK Medical diagnostics goes micro and smart, HBC.2021.0560
Plus d'informations sur le projet
Medical diagnostics goes micro and smart
En savoir plus ?La plupart des techniques de fabrication présentées dans cet article sont disponibles chez Sirris pour la création de vos prototypes microfluidiques préindustriels. Contactez-nous pour plus d’informations
|