Microfluïdica in de industrie
In dit artikel van onze serie over microfluïdische lab-on-chips bespreken we enkele basisprincipes voor het detecteren of kwantificeren van de hoeveelheid biochemisch analyt in een testmonster.
De detectieprincipes bestaan uit één of meer van de volgende elementen:
- de bioreceptor die heel specifiek aan het analyt kan binden,
- een manier om de concentratie van het analyt te verhogen, om de test gevoeliger te maken,
- een optioneel markermolecuul verbonden met de bioreceptor om detectie te vergemakkelijken,
- een sensor die de aanwezigheid of zelfs de hoeveelheid van het gebonden analyt kan meten.
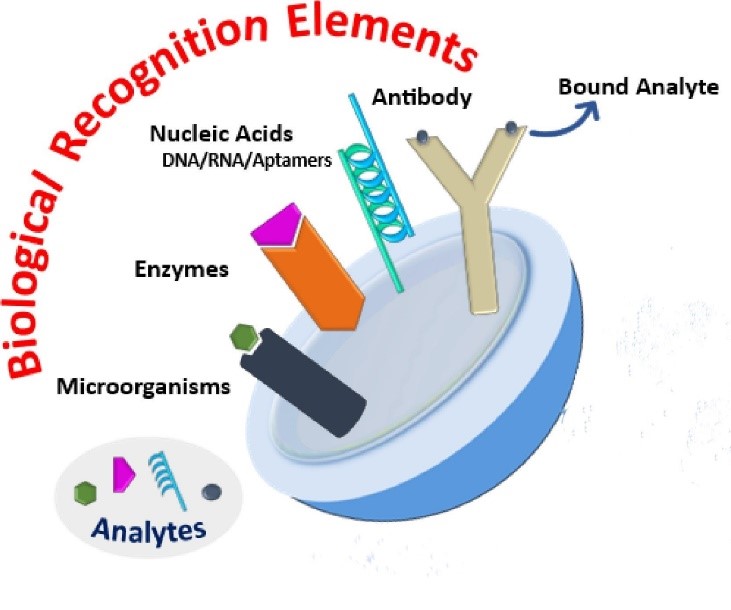
Bioreceptor
Het ontwikkelen van een geschikte bioreceptor is het vakgebied van de biochemische sector. Het is belangrijk dat de bioreceptor selectief is en alleen aan het analyt bindt en niet aan vergelijkbare moleculen in het monster, wat tot vals-positieve resultaten leidt. De bioreceptor is meestal een enzym, een antilichaam of een nucleïnezuur.
Concentratie van het analyt
Een volgend belangrijk aspect zijn de concentratietechnieken, om het meetsignaal te versterken en de detectie betrouwbaarder te maken.
Eén manier om de concentratie te verhogen is door het analyt in het monster te ‘versterken’. Dit is mogelijk wanneer het analyt een nucleïnezuur is, zoals DNA of RNA. Met de polymerasekettingreactie (PCR) kan het specifieke deel van het DNA/RNA dat we moeten detecteren worden gerepliceerd, waardoor de hoeveelheid analyt in het monster wordt verdubbeld. Door dit bijvoorbeeld 30 keer te herhalen, wordt de hoeveelheid analyt 1 miljard keer vermenigvuldigd!
We kunnen de concentratie van het analyt ook verhogen door de bioreceptor op een specifiek detectieoppervlak aan te brengen. Dit oppervlak kan een vast oppervlak zijn in de detectiezone van de microfluïdische chip. De microfluïdische omgeving heeft als voordeel een grote verhouding tussen oppervlak en volume te hebben, waardoor het veel waarschijnlijker is dat de analytmoleculen in contact komen met de bioreceptoren op het oppervlak dan in een macroscopische testomgeving.
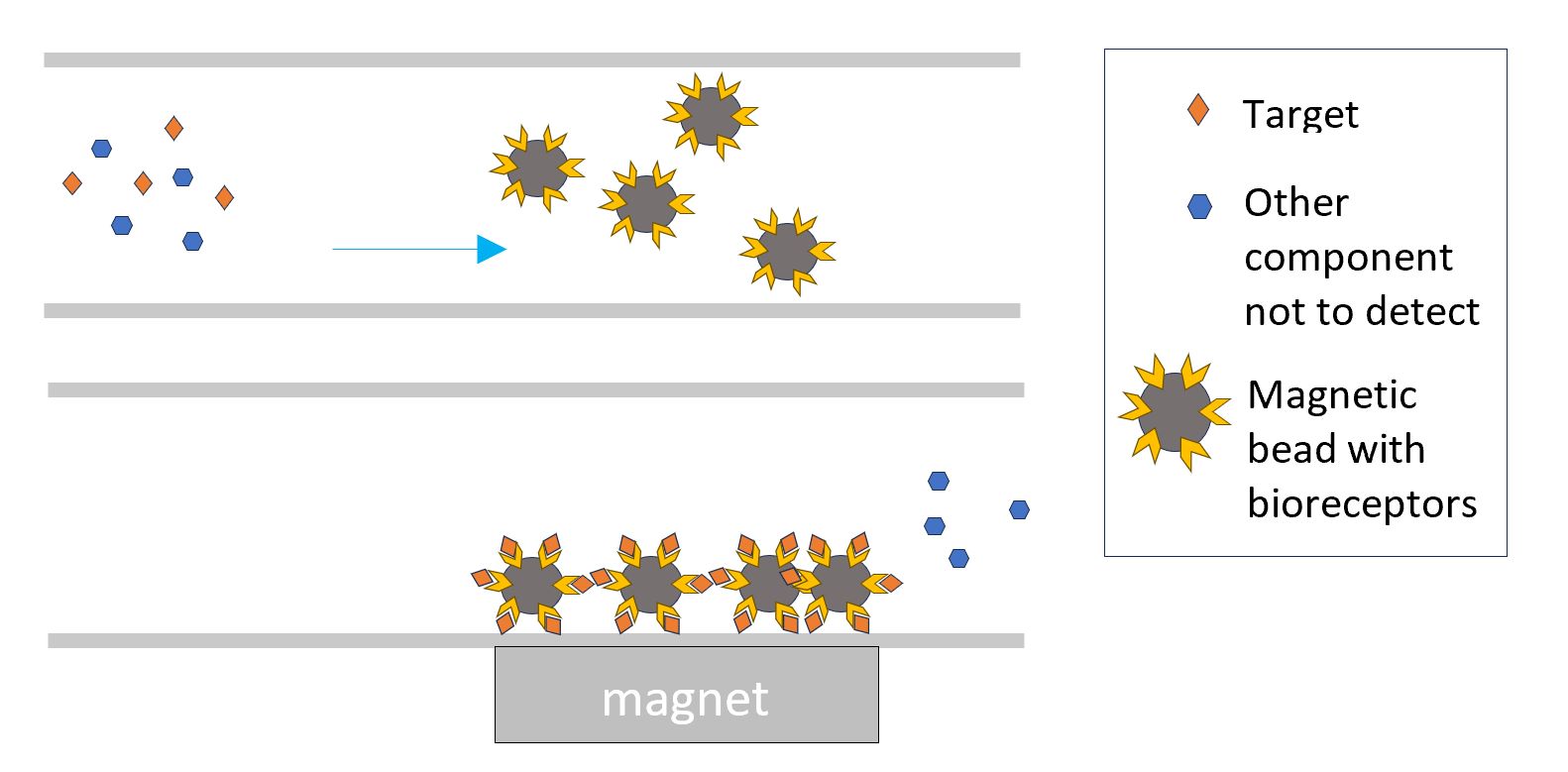
De bioreceptor kan ook aan magnetische deeltjes worden gebonden. De interactie van het analyt met de magnetische deeltjes kan over het volledige volume plaatsvinden in plaats van op een vast oppervlak. Door in een volgende stap de magnetische deeltjes aan te trekken naar een detectiezone in de chip, wordt het gedetecteerde analyt in die zone geconcentreerd.
Op dezelfde manier kunnen de bioreceptoren worden gebonden aan grote deeltjes die in een filterelement kunnen worden opgevangen om het analyt te concentreren.
Detectie van het analyt
Nadat we het gebonden analyt hebben geconcentreerd, gaan we over tot het detecteren ervan. Ook hier hebben we verschillende mogelijkheden.
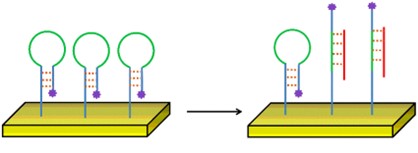
Aan de bioreceptor kan een fluorofoor zijn gebonden, die alleen zichtbaar is wanneer het analyt aan de bioreceptor is gebonden (bijvoorbeeld een ‘haarspeld’-probe). Dit noemen we gelabelde detectie.
Het gebonden analyt of de bioreceptor kan ook elektrochemische eigenschappen hebben, die we kunnen meten door amperometrie, impedantiemeting, potentiometrie of voltammetrie.
De elektrische eigenschappen van het detectieoppervlak (weerstand, capaciteit, inductie) kunnen veranderen afhankelijk van de hoeveelheid gebonden analyt.
Het detectieoppervlak kan mechanisch vervormen door het extra gewicht van het gebonden analyt of de resonantiefrequentie ervan kan verschuiven.
Het analyt zelf of de geactiveerde marker op de bioreceptor kan fluoresceren of licht uitstralen. Het kan de optische eigenschappen van het detectieoppervlak veranderen door invallend licht te absorberen, te verstrooien of te breken. In het eenvoudigste geval verandert het detectieoppervlak van kleur wanneer een grotere hoeveelheid gebonden analyt aanwezig is. Andere technieken maken ook zeer gedetailleerde analyses mogelijk door variaties in de brekingsindex van een oppervlak te meten als functie van de stoffen die zich eraan binden (bijvoorbeeld oppervlakteplasmonresonantie (SPR)).
Sensor
Tot slot kunnen we dan met een sensor de fluorescentie, de lichtintensiteit, het spectrum, of de veranderende elektrische, mechanische of optische eigenschappen van het detectieoppervlak detecteren/monitoren/kwantificeren.
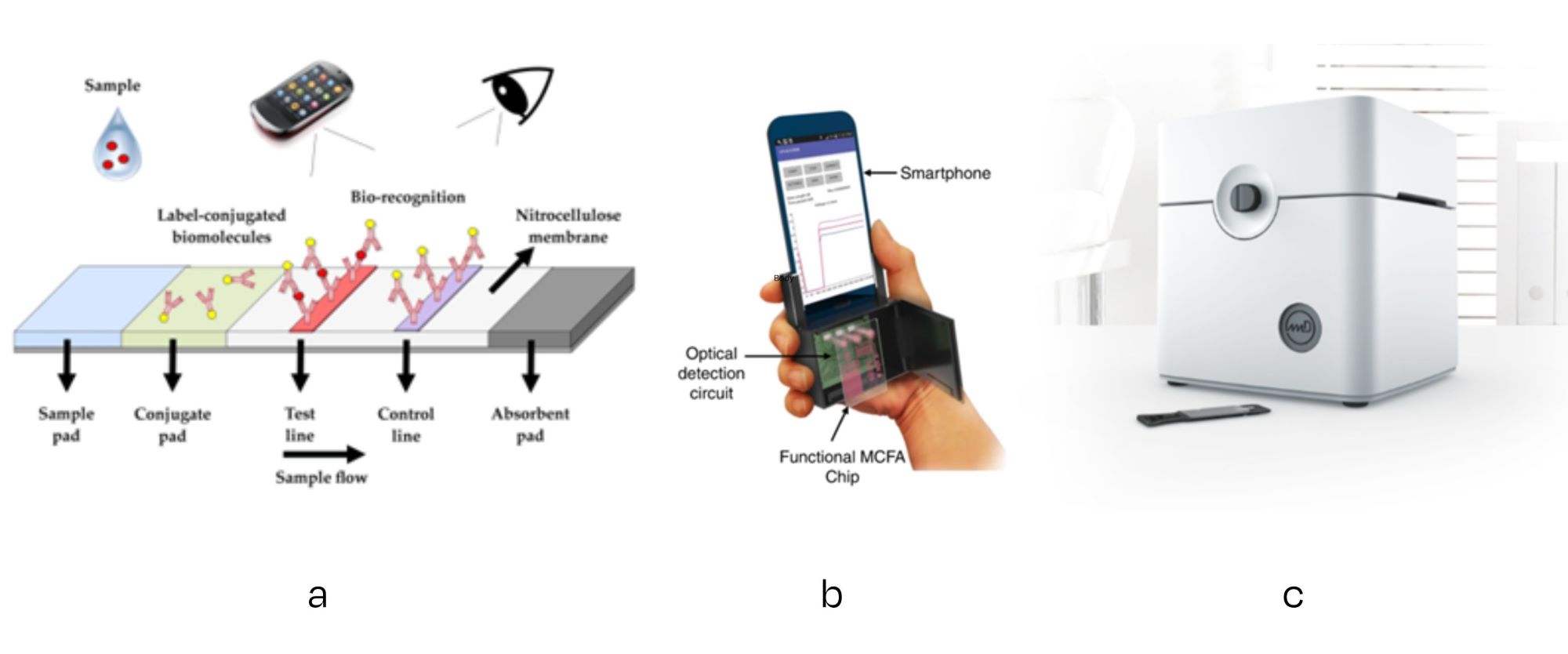
Bij de eenvoudigste oplossing kan de gebruiker met het blote oog de kleurverandering detecteren en aan de hand daarvan het resultaat van de test interpreteren (bijv. zwangerschapstest, covid-zelftest of wissers voor monitoring van hygiëne). Een volgende stap zou het gebruik van een smartphone kunnen zijn om optische veranderingen in het detectiegebied op een meer kwantitatieve manier te interpreteren.
Meer geavanceerde oplossingen bestaan uit op maat gemaakte actuator-/sensorcombinaties, om de benodigde excitatie (spanning/stroom/trilling/licht) toe te passen en de (elektrische, elektrochemische, mechanische, optische) respons te meten. Bepaalde oplossingen zijn relatief eenvoudig en goedkoop te realiseren, bijvoorbeeld een camera voor optische detectie.
Dit is in een notendop hoe we biologische analyten in een monster detecteren, ongeacht het type toepassing (medische diagnose, testen op planten, dieren, het milieu, voedsel …).
In eerdere artikelen hebben we het al gehad over de ontwerpstappen en de prototypingtechnieken voor de ontwikkeling van speciale microfluïdische chips. We hebben ook een op een camera gebaseerde oplossing gepresenteerd om de vloeistofstroom in de chip te regelen. In een volgend artikel zoomen we in op het aspect van thermische controle in de chip, een kritieke factor bij het uitvoeren van PCR.
Project funding
VLAIO COOCK Medical diagnostics goes micro and smart, HBC.2021.0560
More information about the project
Medical diagnostics goes micro and smart
Meer weten?Vergeet niet dat er in België kennis en productiefaciliteiten beschikbaar zijn om lab-on-a-chip-systemen lokaal te ontwikkelen en te produceren, zowel de microfluïdische chip als het conditioneer- en uitleesapparaat. We helpen u graag op weg met uw idee! |